リウマチ性多発筋痛症(PMR)といえば"滑液包炎"という印象もあり、関節リウマチと比較する上でも身体所見・画像所見双方で重要視されてきた。滑液包炎も確かに重要であるが、
上腕二頭筋長頭や膝下筋腱、腱板炎などの炎症、果ては関節包の炎症もあり、近年では
PMRの炎症がperimysium/peritendiumという膜を含む関節周囲から発生しているのでは?という説が提唱されている。今回
Rheumatology Advances in Practiceに掲載された論文は一昨年のACRで発表されていた内容を論文化したもので、PMRの炎症が生じる部位に関して参考になったのでまとめた。
<歴史>
PMRは
1888年にWilliam Bluesが報告したが、以降根底のメ
カニズムを探索する目的で病理学的な検討が行われてきたが
はっきりとした首座は掴めていなかった。
・筋肉の浮腫と血管周囲の軽度の炎症+筋膜への細胞浸潤の記載(Ann Rheum Dis. 1964 Nov;23(6):447-55.)
・肩甲上腕関節の組織ではCD4+T細胞とマクロファージの浸潤を伴う軽度の滑膜炎(Arthritis Rheum. 1996 Jul;39(7):1199-207.)
→
その後PMRの発見から100年ほど経った1999年に発見が。
・Cantini らがPMR患者で高齢発症のRAと比較して肩峰下滑液包炎の頻度が優位に多く関節の滑膜炎や液体貯留・
上腕二頭筋腱の腱鞘滑膜炎は差がないことを超音波で報告した(J Rheumatol.1999 Nov;26(11):2501-2.)
その後
・
MRIを使用して肩に関して関節包の外と軟部の炎症がRAと比較してPMRで優勢であることが確認された(J Rheumatol.2001 Aug;28(8):1837-41.)
・同筆者によって
MCP関節においても関節周囲により強いGd造影効果を認めた(Arthritis Rheum. 2007 Oct;56(10):3496-501).。
上記などからPMRは滑液包や関節周囲に炎症がありそう。
→
PET-CTや造影
MRIでより
個別な解剖構造を正確に理解できるようになった。
・具体的にはRAやSpAと比較して頸部や腰椎の
棘突起間、坐骨結節周囲に高集積を認めた。
・両者とも滑液包によるものと考えられていたが、後者はハムストリング腱周囲炎であることがPET/
MRIの融合研究や造影
MRIで証明された(Rheumatology (Oxford).2018 Feb 1;57(2):345-353.Clin Exp Rheumatol 2018 Sep-Oct;36 Suppl 114(5):86-95.)。

・造影
MRIの研究では腱周囲炎から腱内部の炎症まで描出され、観察された
MRIパターンは
external peritendineumによるものと考えられた。

・実際にTCZの使用によりPMRで観察されるMRIでの筋膜性炎症が消失することも確認されており、筋や腱周囲の膜の関与は注目に値された(J Rheumatol. 2019 Dec;46(12):1619-1626.)。


→以上のような主に
画像からの洞察によりPMRの病態が
"筋肉と腱を取り囲むperimysiumとperitendon"が自己免疫の標的抗原であると考えられている。


<実際にPMR患者でPET集積が起こる部位>
→perimysium・peritendonとそれらに隣接する滑液包や関節包に異常が認められる!
①肩、転子部含む股関節
注意点としては
上腕二頭筋長頭にも炎症が起こり、場合によっては肘の遠位端にも炎症が見られることがある:
腕から肘関節まで痛みがはしる現象を説明しているかも?(確かに筋腹が痛む人がいる気がする・・・)

同様に股関節も寛骨大腿関節周囲に筋肉の起始部にも注目が必要

また、肩や腰の関節内の異常信号は一般的に検出され、RAやSpAの区別はできない(とされている)。
 Eur J Nucl Med Mol Imaging. 2020 Sep;47(10):2461-2468.
Eur J Nucl Med Mol Imaging. 2020 Sep;47(10):2461-2468.
例外的に胸鎖関節の取り込みはPMRに対する特異度が高い。

 Rheumatology (Oxford).2022 Mar 2;61(3):1072-1082.
Rheumatology (Oxford).2022 Mar 2;61(3):1072-1082.
②棘突起間滑液包・・・
下の棘突起の基部から生じ、黄色靱帯の背側表面から上の棘突起の下側まで伸びる狭いスリットで脂肪と(比較的ほとんどいないが)滑膜組織が混在する空間。いわゆる滑液包のように嚢胞状ではない?

Ann Rheum DiS. 1982 Aug;41(4):360-70.

③坐骨結節~膝の内側
坐骨結節周囲の取り込み増加はハムストリング(特に半膜様筋・および
大腿二頭筋長頭の共通腱起始部の腱周囲炎)に対応している。
筋肉量が多く、取り込みも比較的大きい。

膝の集積は線維性関節包と解剖学的に相関があるとされ(Rheumatology (Oxford). 2018 Feb 1;57(2):345-353.)、後面内側の炎症は遠位の半腱様筋の腱周囲炎と薄筋に起因すると考えられている(恥骨結合の炎症も報告されていることからの仮説? Radiol Oncol. 2017 Jan 14;51(1):8-14.)。
④手と手首
末梢関節炎の関与はcontravertialである。一部の専門家は手首や手の腫れがあればseronegative RAと診断している。しかし臨床や画像の観点では、このアプローチはevidenceに基づいたものではなく患者の約半数が手や手首に症状を有しており(Arthritis Rheum. 1998 Jul;41(7):1221-6.)、同様の割合でPET-CTでも取り込みが見られる(Rheumatology (Oxford). IF: 5.5Q12018 Feb 1;57(2):345-353.)。
取り込みの仕方として関節ベースのパターンと掌側のパターンがあり、掌側は屈筋腱鞘炎に対応している。


Rheumatology (Oxford). 2018 Feb 1;57(2):345-353.
RAとの鑑別で
MCP関節の関節包外の炎症が重要であり(Arthritis Rheum. 2007 Oct;56(10):3496-501.)、コトン
トロールと比較して腱鞘炎の発生がはるかに高いことからも関節外の症状は重要である(Rheumatology (Oxford).2011 Mar;50(3):494-9.)。

Arthritis Rheum. 2007 Oct;56(10):3496-501.
 Rheumatology (Oxford).2011 Mar;50(3):494-9.
Rheumatology (Oxford).2011 Mar;50(3):494-9.
⑤血管との関連
PMRの1/5は
GCAを併発するが、
GCAの50%はPMRのような骨格筋症状を経験する。
PMRでも血管に弱い集積を認めることがあるが、LV-
GCAの集積は肝臓と同程度以上の集積である。肝臓以上の集積は治療の価値があるが、弱い集積に治療が必要かどうかは定まっていない。しかし難治性のPMRに
潜在的なLV-
GCAが併発している可能性は高い。
実際にPMRの60.7%で血管に集積を認め、予測因子にはびまん性の下肢痛(OR 8.8)、骨盤部痛(OR 4.8)、炎症性腰痛(OR 4.7)が同定された。

Semin Arthritis Rheum. 2019 Feb;48(4):720-727.
(コメント)
今回のperimysium/peritendium仮説は主に画像からのアプローチであるため病理学・分子学的にも解明が待たれる。2022年には滑液包内のマクロファージにもIL-6やGM-CSFが発現していることがわかっており(Ann Rheum Dis.2023 Mar;82(3):440-442.)
、そのマクロファージの由来を辿れば炎症の元がわかるのだろうか?







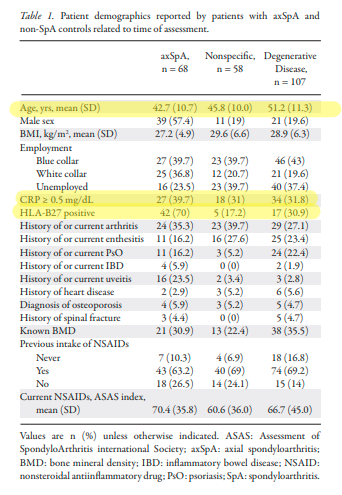
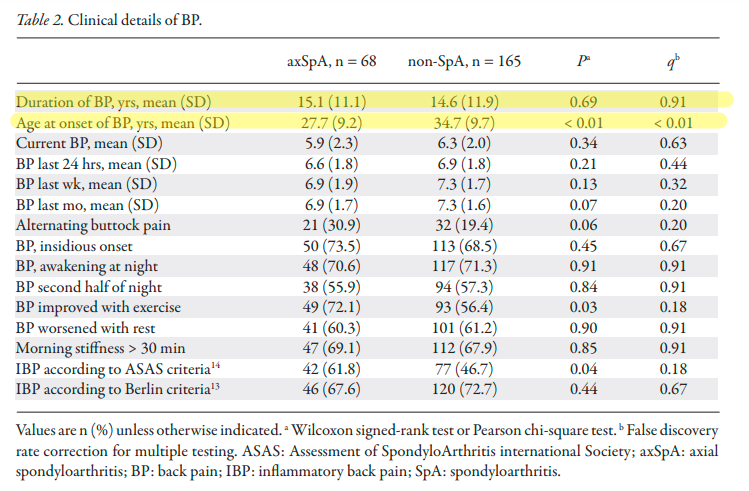
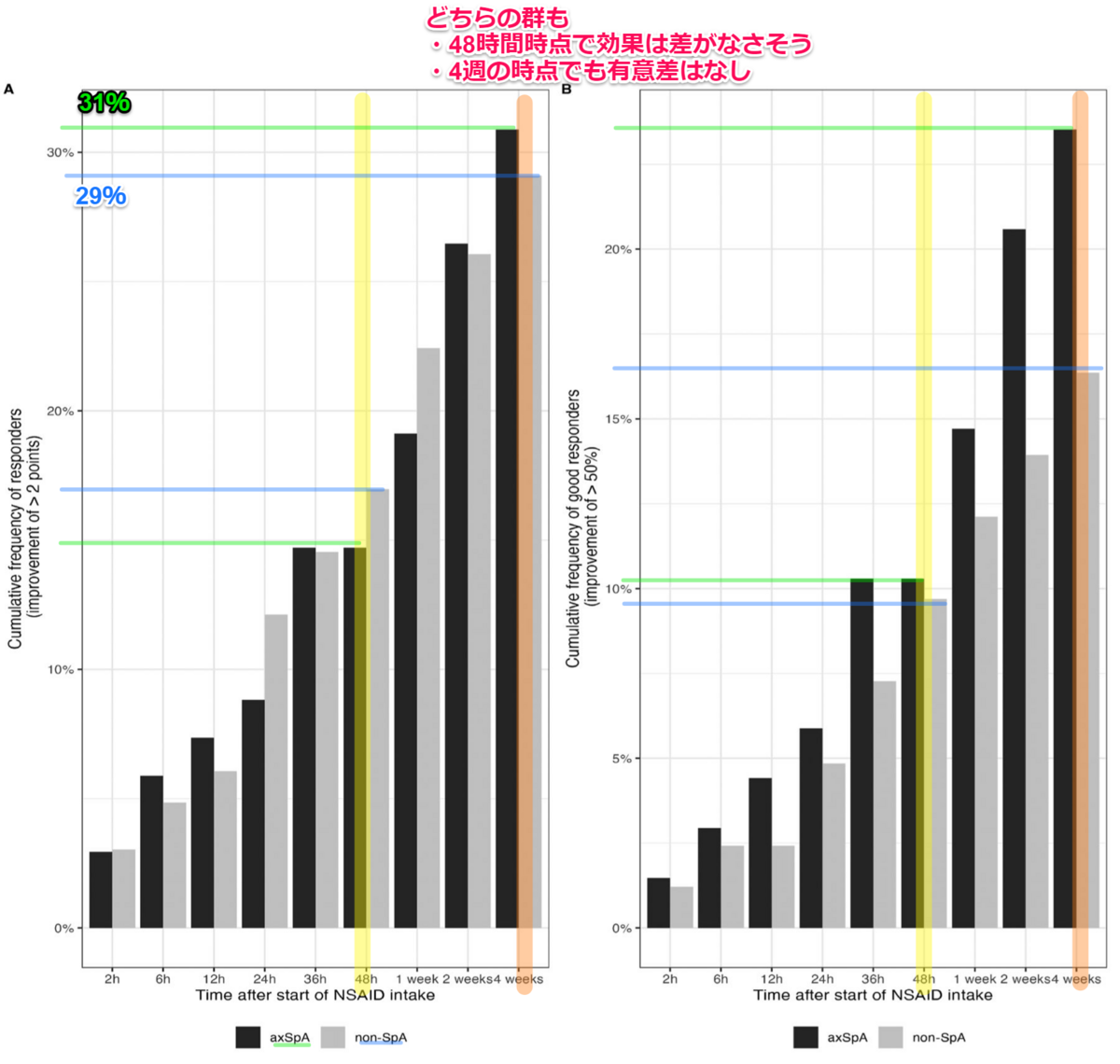
































































 Rheumatology (Oxford).2011 Mar;50(3):494-9.
Rheumatology (Oxford).2011 Mar;50(3):494-9.